Biyoteknolojik ilaç ve aşı üretiminde GMP süreçlerine dair teknik gereklilikler, kalite yaklaşımları, regülasyonlar, denetim mekanizmaları ve sektörel deneyimler paylaşıldı.

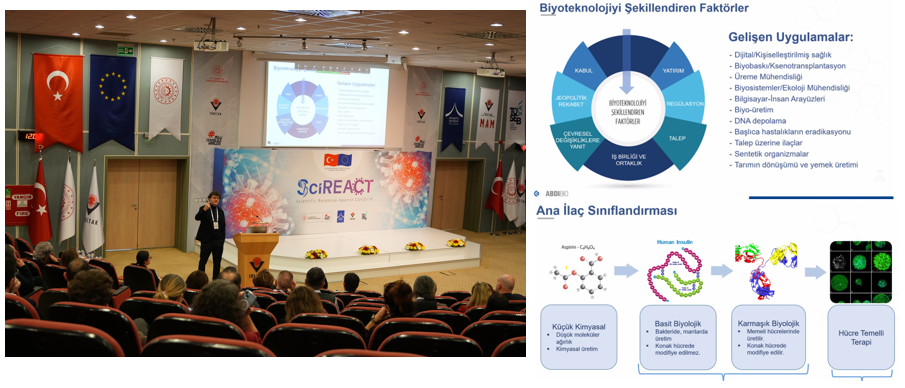
Türkiye ve Avrupa Birliği ortaklığında yürütülen COVID-19’a Karşı Bilimsel Yanıt (SciREACT) Projesi’nin 5. Bilgi Günü, 21 Ocak 2025 tarihinde TÜBİTAK Gebze Yerleşkesi UME Konferans Salonu’nda hibrit (fiziksel ve çevrimiçi) formatta gerçekleştirildi. Biyoteknolojik ilaç ve aşı üretiminde GMP süreçlerine dair teknik gereklilikler, kalite yaklaşımları, regülasyonlar, denetim mekanizmaları ve sektörel deneyimlerin paylaşıldığı etkinlik, sektörün önde gelen uzmanları ve akademisyenlerini bir araya getirdi.
Programın açılış konuşması, TÜBİTAK Marmara Araştırma Merkezi Başkan Yardımcısı Vekili Doç Dr. Özgen Ercan tarafından yapıldı. Doç. Dr. Ercan, Türkiye ve Avrupa Birliği’nin desteğiyle yürütülen SciREACT Projesi kapsamında biyoteknolojik ilaç ve aşı üretiminde uygulanan GMP süreçlerinin önemine değinerek, bu süreçlerin pandemiyle mücadeledeki rolünü ve sağlık sektöründe sürdürülebilir kalite standartlarının oluşturulmasına sağladığı katkıları vurguladı.
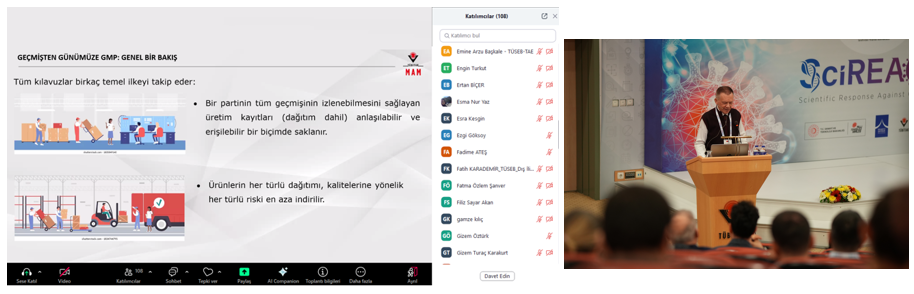
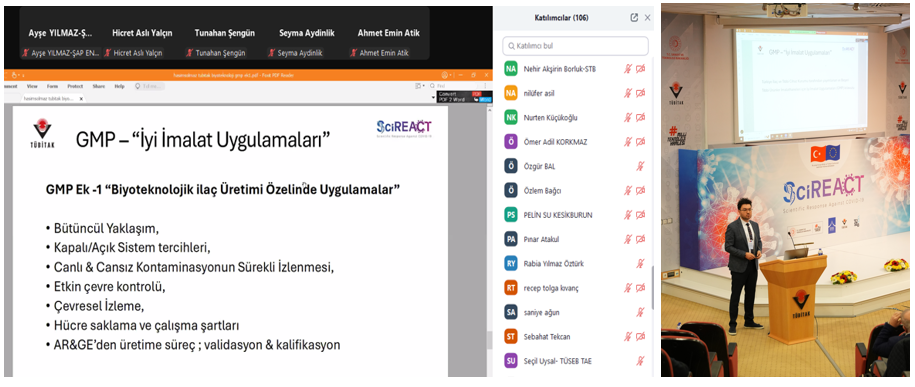
Programın ilk oturumunda, TÜBİTAK MAM BYIYB Biyoteknoloji AG Lideri Lideri Doç. Dr. Hilal Yazıcı Malkoçoğlu, “Biyoteknolojik İlaç ve Aşı Geliştirmede TÜBİTAK MAM’ın Yolculuğu” başlıklı sunumunda, pandemiye karşı yürütülen araştırmalar ve geliştirilen çözümlerde kalite standartları ile GMP uygulamalarının öneminden bahsetti. Ardından, TÜBİTAK MAM BYIYB Biyoteknoloji Araştırma Grubu’ndan Dr. Recep Burak Dürüs, “Geçmişten Günümüze GMP: Genel Bir Bakış” başlıklı sunumunda GMP’nin tarihsel gelişimi, güncel uygulamaları ve biyoteknolojik üretimdeki denetim süreçlerini anlattı.
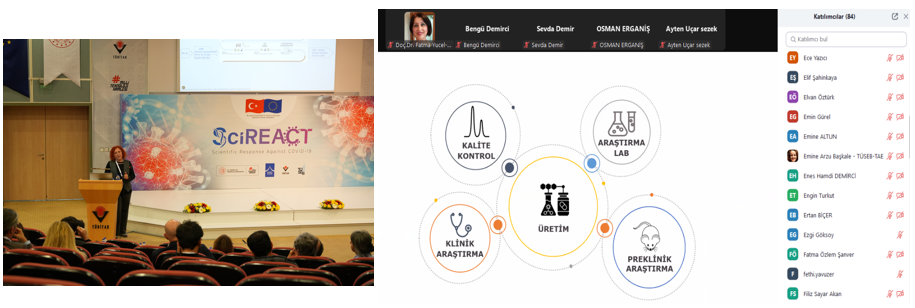
Programın devamında, BPEG Danışmanlık Genel Müdürü Deniz ALKANAT, “Biyoteknolojik İlaç ve Aşı Üretim Süreçlerinde, GMP Alan Kurulumu Teknik Gereklilikleri ve İleri Teknoloji Prosesler” başlıklı sunumunda, GMP standartlarına uygun biyoteknolojik üretim alanlarının kurulumu için gerekli teknik standartlar ve ileri teknoloji süreçlerden bahsetti. Lighthouse Worldwide Solutions EMEA Operasyonları Genel Müdürü Haşim SOLMAZ ise, “Biyoteknolojik İlaç Üretiminde Kontaminasyon Kontrolüne GMP Bakış Açısı” başlıklı sunumunda, biyoteknolojik üretimde sterilizasyon, partikül takibi ve kontaminasyon kontrol yöntemlerini ele aldı.
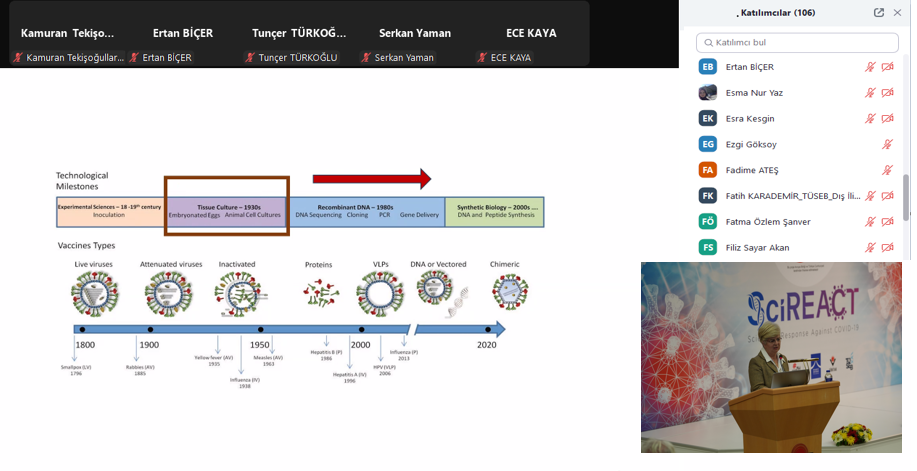
“Biyoteknolojinin Dünü, Bugünü, Yarını ve AbdiBio” başlıklı sunumunda, AbdiBio Grup Başkanı Dr. Ali ÖZÜER, biyoteknolojinin geçmişten günümüze olan değişiminden ve AbdiBio’nun bu süreçte gerçekleştirdiği önemli çalışmalardan bahsetti. RS Research Kurucu Ortağı Sema NOMAK, “GMP Süreçlerine Start-Up Yaklaşımı” sunumunda, GMP süreçlerini start-up firmalarının bakış açısıyla ele aldı. Şap Enstitüsü Hücre ve Virüs Bankası Bölüm Başkanı Dr. Şükran YILMAZ ise “GMP İlkeleri Çerçevesinde Hücre Kültürü Tabanlı Viral Aşı Üretim Süreçleri” başlıklı sunumunda, hücre kültürü tabanlı aşı üretim süreçleri ve uygulanan GMP ilkelerinin önemine değindi.
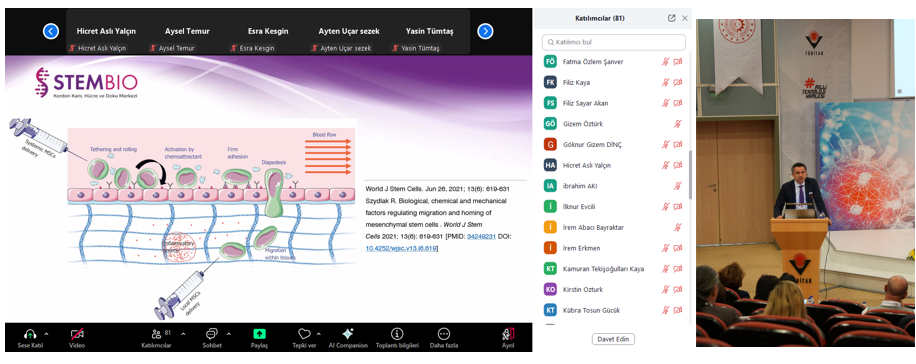
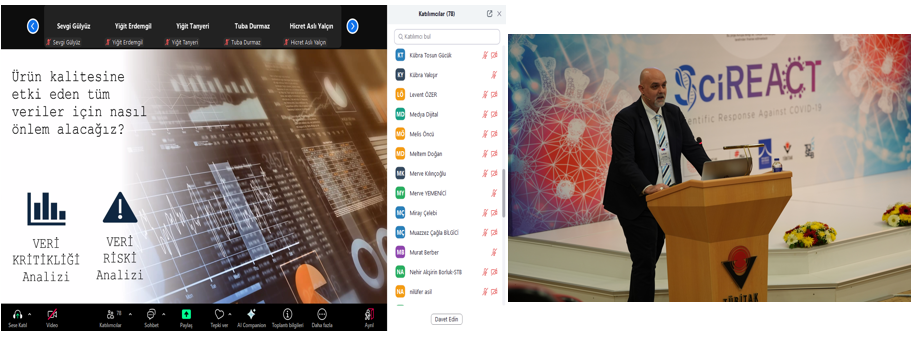
Öğleden sonraki oturumların ilk konuşmasını Dolvet A.Ş. Genel Müdür Yardımcısı ve Ar-Ge Koordinatörü Dr. Nilay ÜNAL gerçekleştirdi. “Aşı Üretiminde cGMP Düzenlemeleri” başlıklı sunumunda, aşı üretiminde uygulanan güncel cGMP düzenlemelerini ve bu düzenlemelerin üretim süreçlerine olan etkisinden bahsetti. STEMBIO Medikal Direktörü Doç. Dr. Durmuş BURGUCU, “Laboratuvardan Kliniğe GMP Koşullarında İnsan Hücre ve Doku Ürünlerinin Üretimi ve Regülasyonlar” başlıklı sunumunda, hücre ve doku ürünlerinin laboratuvar aşamasından klinik uygulamalara geçişindeki zorlukları ve bu süreçlerde uygulanan GMP regülasyonlarını değerlendirdi. Akademia Yaşam Bilimleri Merkezi Eğitim Danışmanı Ersel TAŞÇI ise “İlaç Üretiminde Veri Kritikliliği ve Veri Riski” başlıklı sunumunda, ilaç üretiminde veri güvenliğinin önemi ve bu verilerin risk yönetimi açısından nasıl korunması gerektiğine dair önemli bilgiler sundu.
Programın kapanış oturumlarında, M2H Kurucusu Mustafa MUSTAFA HASAN, “İlaç Ürünü, GMP ve Farmasötik Kalite Sistemi” başlıklı sunumunda, farmasötik kalite sistemlerinin temel ilkelerini ve ilaç üretiminde GMP uygulamalarını detaylandırdı. Ceyda Akşit ŞENER, “FDA Tarihine Kısa Bir Yolculuk” başlıklı sunumunda, biyoteknolojik ilaçların geliştirilme sürecindeki FDA’nın rolünü ve tarihsel gelişimini ele aldı. Etkinliğin son oturumunda ise, TİTCK İlaç Denetim Dairesi Başkanı ve Başmüffetiş olan Dr. Abdullah İbrahim BÜYÜKKURT ve TİTCK İlaç Denetim Dairesi Müfettişi Dr. Çağrı İPEK, “Denetim Perspektifinden GMP” başlıklı sunumlarında, GMP süreçlerinin denetim aşamasındaki önemine ve bu süreçlerin denetim boyutundaki işleyişine dair değerli bilgiler sundular.
Etkinlikteki konuşmaların ardından yapılan değerlendirme oturumunda, katılımcılar biyoteknolojik ilaç ve aşıların üretiminde GMP süreçlerinin rolü, farmasötik kalite sistemlerinin temel ilkeleri, ilaç üretiminde GMP uygulamalarının önemi, regülasyonlar ve denetim mekanizmaları ile üretim süreçlerinin nasıl etkili bir şekilde yönetilebileceğini tartıştılar. Katılımcılar, son olarak TÜBİTAK MAM Aşı ve İlaç Geliştirme Kampüsü ziyaretlerinin ardından biyoteknolojik ilaç ve aşı üretimindeki GMP uygulamalarının sağlık teknolojileri ve ürün geliştirme süreçlerine sağladığı katkıları daha yakından keşfetme fırsatı buldular.